Ostatnie 1/2-etapowe badanie jest w trakcie przeglądu w portfel natury magazyn i publikowane w pole wyszukiwania*Serwer Preprint wykazał, że skoncentrowany na peptydzie aktywator komórek T CoVac-1 i SARS-CoV-2 były skuteczne u osób z niedoborem komórek B.
tło
Nowa pandemia koronawirusa 2019 (COVID-19) wywołana przez SARS-2 (COVID-19) skłoniła do wynalezienia kilku szczepionek, które chronią miliardy ludzi przed ostrym przebiegiem choroby, głównie poprzez wytwarzanie humoralnej lub stymulowanej przeciwciałami odporność. Odporność komórek T ma kluczowe znaczenie dla kontrolowania infekcji SARS-CoV-2, szczególnie u osób, które nie mogą wytworzyć humoralnej odpowiedzi immunologicznej na profilaktyczne szczepienie lub naturalną infekcję. Do tej kategorii należą osoby z dziedzicznym niedoborem limfocytów B i pacjenci z rakiem z niedoborem limfocytów B związanym z leczeniem lub chorobą. Limfocyty T są niezbędne dla wyniku COVID-19 i utrzymania odporności na SARS-CoV-2, a także odporności humoralnej kierowanej przez komórki B.
CoVac-1, zależny od peptydu aktywator komórek T składający się z epitopów komórek T SARS-CoV-2 uzyskanych z kilku białek wirusowych, wraz z agonistą 1 i 2 (TLR 1/2) XS151. Według autorów niniejszego badania odpowiedni profil skuteczności i bezpieczeństwa w badaniu I fazy wśród zdrowych osób dorosłych, biorąc pod uwagę indukcję odpowiedzi limfocytów T specyficznych dla COVID-19. Ta odpowiedź komórek T była lepsza niż indukowana przez COVID-19 lub obecnie zatwierdzone szczepionki SARS-CoV-2.
CoVac-1 zawiera kilka ludzkich antygenów SARS-CoV-2 białych krwinek (HLA)-DR T generowanych z charakterystycznych białek SARS-CoV-2, takich jak nukleokapsyd (N), wypustka (S), błona (M), otoczka ( e), Otwórz ramkę odczytu 8 (ORF 8). Zatem CoVac-1 stymuluje niezależną odporność komórek T na obecne warianty SARS-CoV-2 będące przedmiotem obaw (VOC).
o nauce
W bieżącym badaniu naukowcy przeprowadzili otwarte badanie fazy 1 CoVac-1, obejmujące 54 osoby z nabytym lub wrodzonym niedoborem limfocytów B, które otrzymały pojedynczą dawkę podskórnego CoVac-1 w Niemczech. Głównym celem badania była immunogenność pod względem odpowiedzi limfocytów T indukowanych przez CoVac-1 do dnia 28; Celem drugorzędowym było bezpieczeństwo do dnia 56. Oprócz niedoboru limfocytów B, u połowy pacjentów liczba limfocytów T CD4+ wynosiła <500/μl, co wskazuje na ciężki niedobór odporności w populacji badania.
Zespół ocenił dane dotyczące zdarzeń niepożądanych u pacjentów. Reakcje limfocytów T na sześć epitopów limfocytów T SARS-CoV-2 HLA-DR CoVac-1 mierzono za pomocą ocen enzymatycznych punktów wychwytu immunosorbentu (ELISPOT) w celu określenia immunogenności. Odpowiedzi limfocytów T mierzono u wszystkich kwalifikujących się pacjentów na początku badania/dzień 1., 7., 14. i 28. po otrzymaniu CoVac-1.
konsekwencje
Wyniki badań wykazały, że 94 pacjentów z nabytym lub wrodzonym niedoborem limfocytów B zostało przebadanych w trzech ośrodkach badawczych w Niemczech od 6 lipca 2021 do 13 stycznia 2022 roku. Ponadto CoVac-1 podano 54 pacjentom, 14 w pierwszym etapie Ze względów bezpieczeństwa, 40 jest w fazie 2 części eksperymentu.
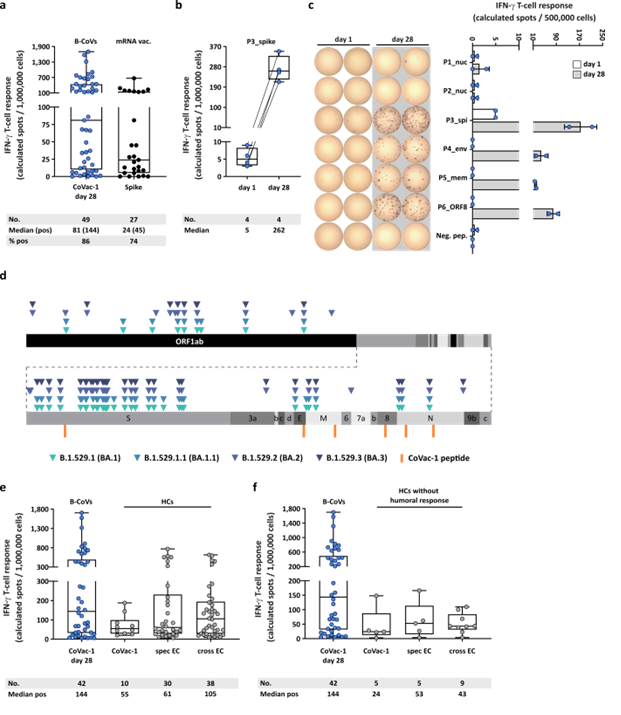
Odpowiedzi komórek T indukowane przez CoVac-1 w stosunku do wariantów Omicron iw porównaniu ze szczepionką mRNA lub odpowiedzią komórek T indukowaną infekcją. (a) Odpowiedzi limfocytów T swoistych wobec CoVac-1 oceniane ex vivo u pacjentów w badaniu (dzień 28) w porównaniu z odpowiedziami limfocytów T swoistymi dla podwyższenia dawki przed podaniem CoVac-1 u pacjentów po drugim lub trzecim szczepieniu zatwierdzonymi szczepionkami mRNA (n = jak pokazano). (b) Intensywność odpowiedzi komórek T indukowanych przez P3_spike oceniona ex vivo u badanych pacjentów (n = jak wskazano) przed iw dniu 28 po podaniu CoVac-1. (c) Typowe testy ELISPOT ex vivo jednego badanego pacjenta (UPN12), z istniejącymi wcześniej odpowiedziami komórek T na P3_spike, na sześć peptydów CoVac-1 w dniu 1 (biały) i dniu 28 (szary). Intensywność odpowiedzi komórek T na IFN g γ przedstawiono jako obliczoną liczbę plamek (średnia liczba plamek powtórzeń technicznych minus odpowiednia kontrola negatywna). (d) Oznaczone kolorem mutacje opisane dla wariantów omikronowych SARS-CoV-2 są pokazane wraz z peptydami CoVac-1 (pomarańczowy). Pozytywne odpowiedzi komórek T na specyficzne (specyficzne) i reaktywne krzyżowo (krzyżowe) cykliczne konstrukty komórek T (EC) w (e) immunokompetentnych HC (CoVac-1, specyfikacja EC, cross-EC, n = jak wskazano) 10, 11 i ( f) immunokompetentne HC bez odpowiedzi przeciwciał na SARS-CoV-2 po zakażeniu (CoVac-1, specyfikacja EC przez EC, n = jak pokazano) w porównaniu z dodatnimi odpowiedziami limfocytów T IFN-γ u pacjentów w badaniu ocenianych poza vivo (B-CoV, n = jak wskazano, dzień 28). (a,b,e,f) Intensywność odpowiedzi komórek T IFNγ-g przedstawiono jako obliczoną liczbę plamek (średnia liczba plamek powtórzeń technicznych minus odpowiednia kontrola negatywna). Wykresy pudełkowe lub połączone wykresy pudełkowe pokazują średnią z 25 lub 75 procentami wąsów min/maks. (c) Słupki ze średnią, SD i pojedynczymi punktami danych. brak numeru; EC, skład epitopu; HCs, rekonwalescencja zdrowotna po COVID-19; ORF, otwarta ramka odczytu; Punkty sprzedaży, pozytywne.
Szczegóły niepożądanych i pożądanych zdarzeń niepożądanych były dostępne dla każdego uczestnika za pośrednictwem kart dzienniczka przez 28 dni po podaniu CoVac-1 i kontroli bezpieczeństwa do 56 dnia. Żaden uczestnik nie został wypisany z badania z powodu skutków ubocznych. Autorzy nie odnotowali stopnia 4 związanego z CoVac-1 ani znaczących skutków ubocznych. Spodziewane powstawanie miejscowego ziarniniaka zaobserwowano u 94% uczestników badania. Z drugiej strony reakcja ogólnoustrojowa zasadniczo nie istniała lub była łagodna.
W dniu 28, selektywne interakcje komórek T SARS-CoV-2 zostały wygenerowane u 86% pacjentów i skierowane na wiele peptydów CoVac-1, średnio cztery z sześciu peptydów zidentyfikowanych przez limfocyty T pacjentów. Na odpowiedzi te nie miały wpływu żadne mutacje omikronowe SARS-CoV-2 i były one regulowane przez multipotencjalne limfocyty T-pomocnicze 1 (Th1) CD4+. Te komórki Th1 były dodatnie dla interferonu (IFN-γ), CD107a, interleukiny-2 (IL-2) i czynnika martwicy nowotworu (TNF).
Zgodnie z analizą podgrup, w dniu 28 osoby z nabytym niedoborem limfocytów B miały wyższe wskaźniki odpowiedzi i odsetek limfocytów T indukowanych CoVac-1 niż osoby z wrodzonym niedoborem limfocytów B. Nie było widocznych różnic w częstotliwości i sile odpowiedzi limfocytów T indukowanych przez CoVac-1 między pacjentami z rakiem otrzymującym terapię anty-CD20 a tymi, którzy tego nie robili.
Ponadto, u osobników z niedoborem komórek B i osobników nieseropozytywnych/nieseropozytywnych leczonych COVID-19, odpowiedzi komórek T indukowane CoVac-1 przewyższały odpowiedzi komórek T swoistych dla S po immunizacji szczepionkami mRNA. CoVac-1 był również w stanie złagodzić istniejące wcześniej odpowiedzi komórek T.
Żaden z uczestników nie wykazał żadnej humoralnej odpowiedzi immunologicznej na SARS-CoV-2, gdy uwzględniono badanie, pomimo otrzymania więcej niż dwóch dawek zatwierdzonych szczepionek COVID-19. Jednak u pacjentów po podaniu pojedynczej dawki CoVac-1 zaobserwowano wytwarzanie przeciwciał niskiej jakości immunoglobuliny G (IgG) przeciwko SARS-CoV-2, pomimo utrzymujących się ujemnych wyników reakcji łańcuchowej polimerazy SARS-CoV-2 (PCR). .
Wnioski
Obecne badanie wykazało immunogenność, interakcję i bezpieczeństwo CoVac-1 w grupach wysokiego ryzyka z nabytym lub wrodzonym niedoborem limfocytów B. Nawet w tej próbce o bardzo obniżonej odporności badanie to potwierdziło doskonałe wyniki w zakresie bezpieczeństwa i wykazało silną aktywację odpowiedzi komórek T po pojedynczej dawce CoVac-1.
Autorzy stwierdzają, że dzięki swojemu odrębnemu profilowi bezpieczeństwa, CoVac-1 wywołuje szerokie i silne odpowiedzi komórek T u osób z niedoborem przeciwciał/komórek B, niezależnie od tego, które SARS-CoV-2 VOC są obecne. Aktualne dane potwierdzają przeniesienie CoVac-1 do kluczowego badania 2/3 dotyczącego skuteczności i bezpieczeństwa. Obecnie trwają długoterminowe badania skuteczności fazy 2/3 z użyciem CoVac-1 w celu określenia fenotypów i częstości występowania limfocytów T potrzebnych do leczenia COVID-19.
*Ważna uwaga
Preprinty z polem wyszukiwania Publikacja pierwotnych doniesień naukowych, które nie zostały zrecenzowane i dlatego nie powinny być traktowane jako rozstrzygające, ukierunkowywać praktykę kliniczną/zachowania związane ze zdrowiem lub być traktowane jako ustalone informacje.

„Całkowity miłośnik kawy. Miłośnik podróży. Muzyczny ninja. Bekonowy kujon. Beeraholik.”






More Stories
Prognoza cukrzycy w Australii w 2024 r. | Wiadomości o Mirażu
„Gorąca sauna żabia” pomaga australijskim gatunkom w walce ze śmiercionośnym grzybem
Model sztucznej inteligencji poprawia reakcję pacjentów na leczenie raka